MesoCardio
Modélisation de la contraction cardiaque à la méso-échelle
Vue en coupe de myofibrilles en parallèle © Huxley, H. E. The Double array of filaments in cross-striated muscle. J Biophys Biochem Cytol 3, 631–648 (1957) https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2224118/ .
Axe Vivant
Mathématiques
∩ Médecine
Aperçu
Développer des modèles mathématiques du tissu cardiaque tenant compte des phénomènes physiques et physiologiques opérant à l’échelle mésoscopique, en s’appuyant sur la modélisation multi-échelle déterministe et stochastique.
Mots clefs
Contraction cardiaque, moteurs moléculaires, modélisation multi-échelle, système stochastique en champ moyen, coarse-graining, homogénéisation, mécanique des milieux continus.
Coordination
- Julien Reygner (Mathématiques, CERMICS, École nationale des ponts et chaussées)
- Matthieu Caruel (Biomécanique, MSME, UMR 8208, Université Paris-Est Créteil)
Financement
- 594 k€ sur 57 mois (Projet scientifique lauréat de l’appel à projets 2024)
Résumé
Le projet scientifique MesoCardio met en place un consortium interdisciplinaire pour développer des modèles de la contraction cardiaque à l’échelle mésoscopique permettant de simuler les mécanismes physiologiques de sa régulation. Le programme de travail englobe la modélisation en mécanique statistique, l’analyse mathématique des systèmes stochastiques, la mécanique des milieux continus non linéaire et l’homogénéisation, le développement de méthodes numériques innovantes, ainsi que des expériences in situ.
La contraction musculaire est générée par des protéines nanométriques appelées moteurs moléculaires, assemblées en unités contractiles. À l’échelle mésoscopique, ces unités forment un réseau régulier soutenu par des protéines cytosquelettiques élastiques (titin, M-line, Z-line). Ce réseau contractile est le principal constituant des fibres musculaires à l’échelle macroscopique.
Actuellement, la plupart des modèles mécaniques des tissus musculaires ne prennent pas en compte l’échelle mésoscopique, et couplent directement des modèles de type »champ moyen » de moteurs moléculaires à échelle nanométrique aux lois de conservation de la mécanique des milieux continus à l’échelle macroscopique. Cette approche est insuffisante pour modéliser des systèmes avec un faible nombre de moteurs (fluctuations), et pour comprendre le rôle fondamental joué par certaines protéines cytosquelettiques dans la régulation de la contraction (rétroaction mécanique) et dans la préservation de l’intégrité mécanique des fibres (homogénéisation).
Ce projet vise à développer des modèles mathématiques capables de décrire ces phénomènes opérant à l’échelle mésoscopique.
- Développer une stratégie de réduction de modèle pour formuler un modèle effectif d’une unité contractile de taille finie. Ce modèle pourra être utilisé pour représenter fidèlement des situations biologiques avec un faible nombre de moteurs impliqués (par exemple lors de l’activation) ou des expériences in vitro spécifiques.
- Formuler un modèle stochastique d’unités contractiles en interaction, incluant les mécanismes d’activation et régulation, et réaliser des expériences de validation. Les formulations réduites pourront être intégrées dans ce modèle pour diminuer le coût de simulation.
- Proposer une formulation homogénéisée de ce réseau d’unités contractiles à coupler avec les lois de conservation macroscopiques dans le cadre de la mécanique des milieux continus.
- Outils mathématiques : Modèles stochastiques en champ moyen, métastabilité et grandes déviations, dynamique effective, homogénéisation.
- Données : Simulations numériques, données expérimentales.
- Améliorer la compréhension de phénomènes biologiques dont les altérations sont à l’origine de nombreuses cardiomyopathies.
- Enrichir des outils d’analyse mathématique et de simulation numérique existants pour en améliorer les capacités prédictives en contexte clinique et pour le développement de nouveaux traitements.
- Soutenir une initiative pluridisciplinaire et promouvoir le développement de méthodes mathématiques avancées pour la physiologie.

© Huxley, H. E. The Double array of filaments in cross-striated muscle. J Biophys Biochem Cytol 3, 631–648 (1957). https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2224118/
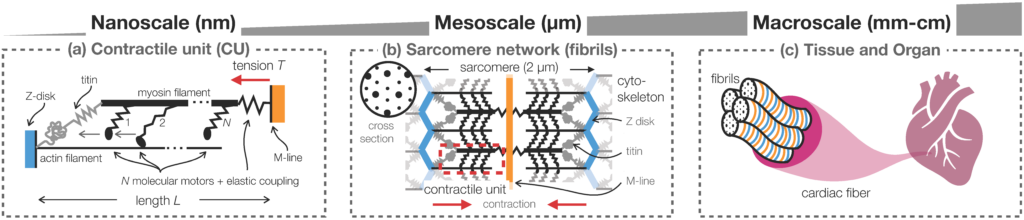
© M. Caruel
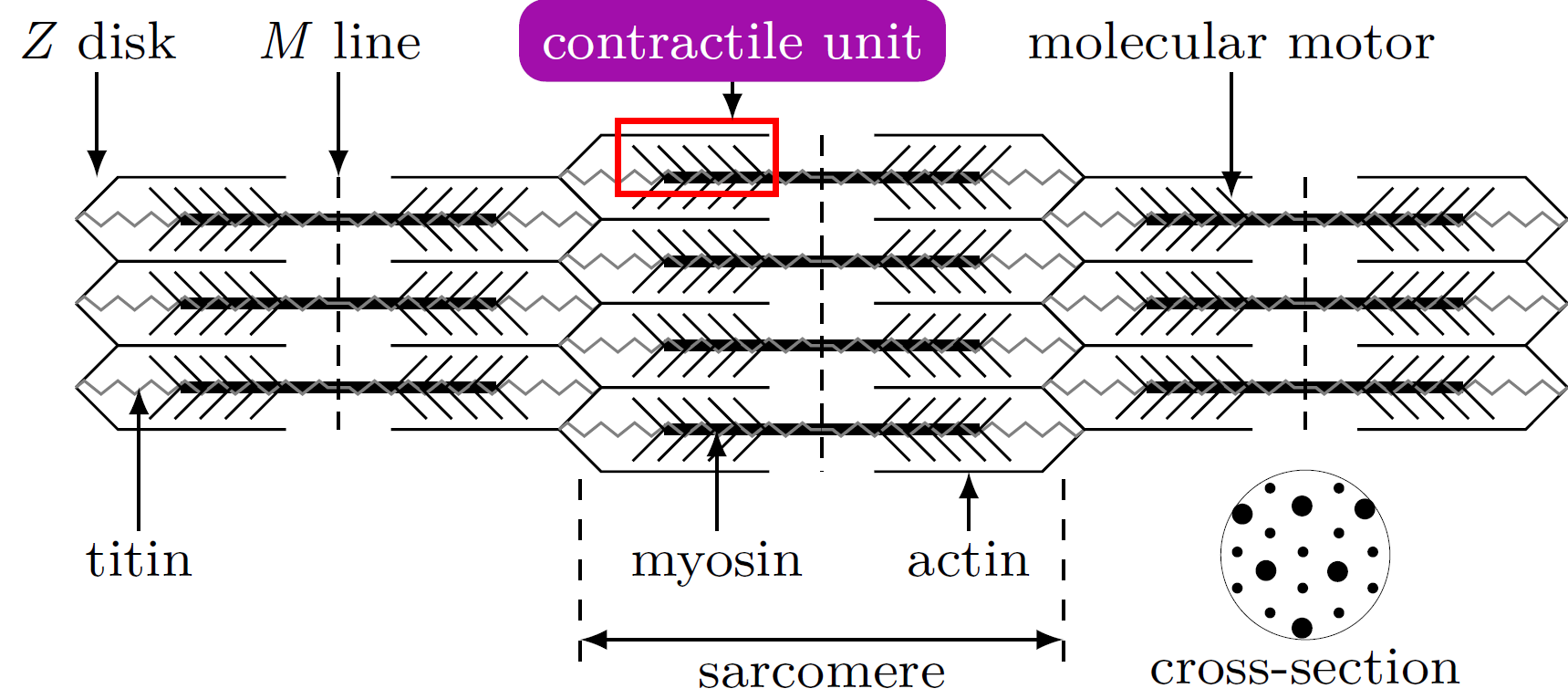
© M. Caruel. Image publiée dans https://iopscience.iop.org/article/10.1088/1361-6633/aa7b9e
Recrutements envisagés
- 2 Masters
- 2 doctorats
- 1 post-doctorat
Plus de projets